QUÍMICA CUÁNTICA
Entendiendo la materia
Primero veamos el descubrimiento del electrón.
Bueno, ahora ya sabemos de la existencia de una partícula constituyente de la materia el electrón y que hubo un cálculo para llegar a su valor de carga y es de 1,602×10-19 coulombios. (si, en aquél cálculo en múltiplos de 40)
Seguimos con el fenómeno que determinó un efecto de la luz sobre la materia y escencialmente con las partículas llamadas electrones.
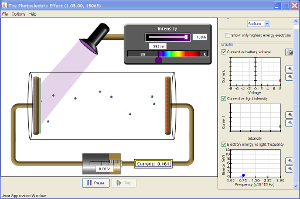
El efecto fotoeléctrico
Bien, ahora que ya experimentaste con el tipo de luz y su intensidad y algunos materiales veamos como podemos localizar al electrón, es decir, queremos decir con exactitud en donde se localizan en el átomo, se había propuesto algunos modelos para explicar la distribución de la materia en el átomo se llegó a lo siguiente:
| Historia: modelos atómicos |
|
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración. |
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Al mismo tiempo de esto, se estudiaba por otra parte el comportamiento dual de la luz
y la conclusión es que en efecto es un conejo-pato pero llamado de otro modo ONDA-PARTÍCULA
La dualidad onda-corpúsculo, también llamada dualidad onda-partícula, resolvió una aparente paradoja, demostrando que la luz puede poseer propiedades de partícula y propiedades ondulatorias.
De acuerdo con la física clásica existen diferencias entre onda y partícula. Una partícula ocupa un lugar en el espacio y tiene masa mientras que una onda se extiende en el espacio caracterizándose por tener una velocidad definida y masa nula.
Actualmente se considera que la dualidad onda-partícula es un “concepto de la mecánica cuántica según el cual no hay diferencias fundamentales entre partículas y ondas: las partículas pueden comportarse como ondas y viceversa”. (Stephen Hawking, 2001)
Éste es un hecho comprobado experimentalmente en múltiples ocasiones. Fue introducido por Louis-Victor de Broglie, físico francés de principios del siglo XX. En 1924 en su tesis doctoral propuso la existencia de ondas de materia, es decir que toda materia tenía una onda asociada a ella. Esta idea revolucionaria, fundada en la analogía con que la radiación tenía una partícula asociada, propiedad ya demostrada entonces, no despertó gran interés, pese a lo acertado de sus planteamientos, ya que no tenía evidencias de producirse. Sin embargo, Einstein reconoció su importancia y cinco años después, en 1929, De Broglie recibió el Nobel en Física por su trabajo.
EN QUE ME QUEDE?... AHHH SI
La distribución de la materia en los átomos y sus diferentes modelos propuestos, así que llegó la hora de que haga su aparición el héroe de la historia
Irwing Schröendinger
a mi novia le hice un dibujito en su, en su en su...
y ESTA FUNCIÓN al graficarla nos queda de la siguiente forma:
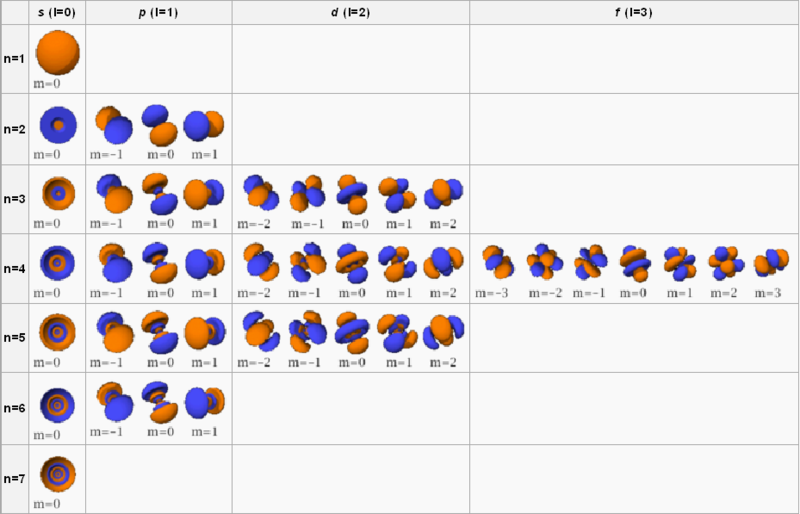
Sólo estamos representando S y P es decir para valores de n= 1 n= 2
n?,
si n es un número cuántico para obtener los:
Orbitales atómicos
El modelo mecano-cuántico del átomo es un modelo matemático basado en la Ecuación de Schrödinger. Las soluciones son unos números llamados números cuánticos. Se simbolizan de la siguiente forma:
n: Número cuántico principal. Toma valores desde enteros positivos, desde n = 1 hasta n = 7. Nos indica la energía del orbital y su tamaño (cercanía al núcleo).
l: Número cuántico secundario o azimutal. Toma valores desde 0 hasta (n-1). Nos indica la forma y el tipo del orbital.
- Si l = 0 el orbital es tipo s. (Se presentan de 1 en 1).
- Si l = 1 el orbital es tipo p. (Se presentan de 3 en 3).
- Si l = 2 el orbital es tipo d. (Se presentan de 5 en 5).
- Si l = 3 el orbital es tipo f. (Se presentan de 7 en 7).
m: Número cuántico magnético. Toma valores desde -l hasta +l pasando por 0. nos indica la orientación espacial del orbital.
s: Número cuántico de spin. Toma valores -1/2 y 1/2. Nos indica el giro del electrón en un sentido o el contrario.
Por ejemplo, si n = 1 entonces l = 0 sólo hay un orbital, el 1s. Si n = 2, tenemos l = 0 (1 orbital 2s) y l = 1 (3 orbitales 2p). Si n = 3, tenemos l = 0 (1 orbital 3s), l = 1 (3 orbitales 3p) y l = 2 (5 orbitales 3d). Si n = 4, tenemos l = 0 (1 orbital 4s), l = 1 (3 orbitales 4p), l = 2 (5 orbitales 4d) y l = 3 (7 orbitales 4f).
Entonces... ahora si :
JUNTEMOS
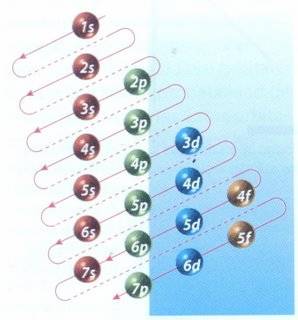
El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de un átomo. El modelo, formulado por el físico Niels Bohr, recibió el nombre de Aufbau (del alemán Aufbauprinzip: principio de construcción) en vez del nombre del científico. También se conoce popularmente con el nombre de regla del serrucho.
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía.
TENEMOS:
El modelo mecano-cuántico del átomo es un modelo matemático basado en la Ecuación de Schrödinger. Las soluciones son unos números llamados números cuánticos. Se simbolizan de la siguiente forma:
n: Número cuántico principal. Toma valores desde enteros positivos, desde n = 1 hasta n = 7. Nos indica la energía del orbital y su tamaño (cercanía al núcleo).
l: Número cuántico secundario o azimutal. Toma valores desde 0 hasta (n-1). Nos indica la forma y el tipo del orbital.
- Si l = 0 el orbital es tipo s. (Se presentan de 1 en 1).
- Si l = 1 el orbital es tipo p. (Se presentan de 3 en 3).
- Si l = 2 el orbital es tipo d. (Se presentan de 5 en 5).
- Si l = 3 el orbital es tipo f. (Se presentan de 7 en 7).
m: Número cuántico magnético. Toma valores desde -l hasta +l pasando por 0. nos indica la orientación espacial del orbital.
s: Número cuántico de spin. Toma valores -1/2 y 1/2. Nos indica el giro del electrón en un sentido o el contrario.
Por ejemplo, si n = 1 entonces l = 0 sólo hay un orbital, el 1s. Si n = 2, tenemos l = 0 (1 orbital 2s) y l = 1 (3 orbitales 2p). Si n = 3, tenemos l = 0 (1 orbital 3s), l = 1 (3 orbitales 3p) y l = 2 (5 orbitales 3d). Si n = 4, tenemos l = 0 (1 orbital 4s), l = 1 (3 orbitales 4p), l = 2 (5 orbitales 4d) y l = 3 (7 orbitales 4f).
Entonces... ahora si :
JUNTEMOS
Heisenberg
Pauli
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual) en el mismo sistema cuántico ligado.1 Perdió la categoría de principio, pues deriva de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin.El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de un átomo. El modelo, formulado por el físico Niels Bohr, recibió el nombre de Aufbau (del alemán Aufbauprinzip: principio de construcción) en vez del nombre del científico. También se conoce popularmente con el nombre de regla del serrucho.
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía.
TENEMOS:
NUESTROS AGRADECIMIENTOS AL EQUIPO DORADO CUÁNTICO




















:) bien profe
ResponderEliminarExelente profe, seria un buen libro
ResponderEliminar¡Genial!
ResponderEliminar:) Que genial
ResponderEliminarProfe Víctor ya vi tu página
ResponderEliminarPVic ya vi tu pagina
ResponderEliminarProfe vic ya vi tu pagina(Hassel)
ResponderEliminarQue bien profe
ResponderEliminarTa bien padre, ya lo vi (soy ricardo)
ResponderEliminarMuy interesante profe
ResponderEliminar